- 时间点:
- 时 分 秒 当前视频时间点
- 问题:
-
- 选项一
设为正确答案
新增选项 - 选项一
- 正确跳转时间:
- 时 分 秒 同锚点时间
- 错误跳转时间:
- 时 分 秒 同锚点时间




恭喜你,回答正确~
很遗憾,回答错误~
正确答案: ,您可以



本节内容主要包括两部分:①铁单质;②铁的重要化合物,主要是铁的氧化物、氢氧化物、铁盐和亚铁盐。教材按照“铁单质→铁的氧化物→铁的氢氧化物→铁盐和亚铁盐”的顺序编排。
对于铁盐和亚铁盐,教材先通过实验介绍铁离子的检验,在此基础上,再通过实验讨论了铁离子被还原成亚铁离子及亚铁离子被氧化成铁离子,并运用氧化还原反应原理,总结出铁离子和亚铁离子的相互转化关系。最后,通过“思考与交流”栏目把铁及其化合物的相互转化关系进一步系统化和网络化。
铁的化合物知识还可以为前面的实验、物质分类、离子反应以及氧化还原理论知识补充感性认识的材料,加强学生对物质分类、离子反应以及氧化还原的认识,同时通过这节课的学习,还可以帮助学生巩固学习元素化合物的基本思路。
介绍了铁及其化合物的基本知识后,为了充分体现这部分内容对发展学生学科核心素养的意义,教材一方面在“方法导引”中总结了认识元素及其化合物性质的视角,另一方面依托多种真实情境设计了多个栏目。例如,以电子工业中制作印刷电路板的真实情境为背景,结合“探究”栏目,通过实现Fe3+和Fe2+的相互转化,引导学生利用氧化还原反应原理解决实际问题;这些真实、生动、有意义的教学情境,不仅可以激发学生的学习兴趣,引导学生积极主动地学习;还可以使学生学会在真实情境中运用知识解决简单的化学问题,促进学科核心素养的形成。
知识储备:学生已掌握实验基本方法和基本操作,对物质的分类、离子反应,氧化还原反应也有了一定认识,前几节课也应用这些原理学习了金属元素钠的性质,这为探究金属元素铁的性质打好了基础。由于第一章刚学习了氧化还原和离子反应知识,学生还不能灵活应用,对离子反应方程式的书写可能会有问题,尤其是氧化还原型的离子方程式的书写对学生是难点。
心理特征:学生思维活跃,比较积极主动获取知识,这为学习提供了动力,但是学生又处于发展成熟期,思维特点处于形象到抽象的过渡期,这就需要老师进行积极有效的引导,降低难度。
宏观辨识与微观探析:掌握铁盐和亚铁盐化学性质,了解铁离子和亚铁离子的常用检验方法。
变化观念与平衡思想:运用氧化还原反应理论分析铁、亚铁离子与铁离子相互转化。
证据推理与模型认知:能依据实验证据推出合理的结论,构建“铁三角”转化关系模型,运用模型解释化学问题。
科学探究与创新意识:设计铁离子和亚铁离子相互转化探究实验方案,与学生合作完成实验探究,培养初步的科学探究能力。
科学态度与社会责任:结合应用实例,将铁盐和亚铁盐的性质的知识运用于解决生产、生活中简单的化学问题,强化性质决定用途的观念。
重点:铁盐与亚铁盐的转化、Fe3+的检验。
难点:Fe、Fe2+、 Fe3+ “铁三角”转化关系模型的建构。
铁盐和亚铁盐
1.铁盐:Fe3+的盐
①Fe3+的检验:滴KSCN溶液,若溶液变红,证明有Fe3+
②Fe3+转化为Fe2+
2Fe3++Fe=3Fe2+
2. 亚铁盐:Fe2+的盐
①Fe2+转化为Fe3+
2Fe2++Cl2=2Fe3++2Cl- 2Fe2++H2O2+2H+=2Fe3++2H2O
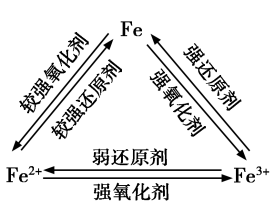
2.Fe和Fe3+和Fe2+的转化:
【魔术设疑】
课前选择一张干净的滤纸,剪一个“铁”字。老师首先将“铁”字放入盛有少量近为无色(约带浅绿色,因浓度稀,颜色不明显)溶液
(氯化铁和KSCN的混合溶液)的烧杯中,然后再放入另一杯盛有无色溶液(H2O2溶液)的烧杯中。放入第一杯液体中,“铁”字依然是白色的,放入第二杯液体中,“铁”变成红色了。魔术很精彩,魔术后面的真相更精彩,同学们想揭开这魔术后面的真相吗?
【过渡】下面我们开始探秘,一起揭开真相。
【讲述】在同学们面前的桌子上帮大家准备了氯化铁,硫酸铁,氯化亚铁,硫酸亚铁,请大家观察颜色。
【学生】氯化铁(FeCl3)、硫酸铁(Fe2(SO4)3)-------棕黄色
氯化亚铁(FeCl2)、硫酸亚铁(FeSO4)--------浅绿色
【分小组实验】实验3-2:在两支试管中分别加入少量的FeCl3溶液和FeCl2溶液,各滴入几滴KSCN溶液。
【学生活动】仔细观察上面的教师演示实验,复述一下教师的实验操作以及你所观察到的实验现象,
并得出结论。
Fe3+ |
Fe2+ |
|
原溶液颜色 |
棕黄色 |
浅绿色 |
实验现象 |
溶液由棕黄色变成红色 |
无明显现象 |
离子方程式 |
Fe3++3SCN- = Fe(SCN)3 |
|
结论 |
Fe3+遇SCN-显红色,可利用此现象检验Fe3+的存在 |
Fe2+与SCN- 不反应 |
【结论】通过上面的实验得出,Fe2+与SCN- 不反应,三价铁遇见SCN-显红色。
【应用】可利用此KSCN(硫氰化钾)来确定Fe3+ 的存在和鉴别Fe3+、 Fe2+。
【板书】1.Fe3+的检验
【设问】同学们现在能不能揭开魔术真相的奥秘呢?
【学生揭秘】白色“铁”字变为红色的“铁”字,是三价铁遇见SCN-显红色。
【设疑】那为什么再放入无色液体后才变红色?
【过渡】那我们继续来探究其中真相的奥秘。
【分小组实验】实验3-3:在盛有2mLFeCl3溶液的试管中,加入少量铁粉,振荡试管。充分反应后,滴入几滴KSCN溶液,观察并记录实验现象。把上层清液倒入另一支试管中,再滴入几滴氯水,又有什么现象。
【学生活动】观察上面的实验,同学们互相讨论看到的实验现象,找学生总结一下实验的具体现象是什么。并试着书写出相关反应过程的离子反应方程式,并试着总结,二价铁离子与三价铁离子之间相互转换的条件。
现象 |
离子方程式 |
|
加入铁粉 |
溶液由棕黄色变成浅绿色 |
2Fe3+ +Fe=3Fe2+ |
滴入KSCN溶液 |
无明显变化 |
|
滴入氯水 |
溶液变为红色 |
2Fe2+ +Cl2=2Fe3++2Cl- Fe3++3SCN-=Fe(SCN)3 |
加入H2O2 |
溶液变为红色 |
2Fe2++H2O2+2H+=2Fe3++2H2O Fe3++3SCN-=Fe(SCN)3 |
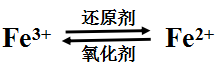
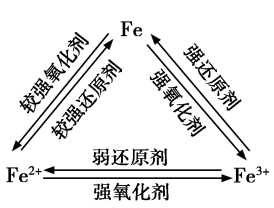
【讲述】在上述实验中,FeCl3中的Fe3+被铁粉还原成Fe2+,Fe2+又被Cl2 、H2O2 氧化成Fe3+。Fe3+遇到较强的还原剂时,会被还原成Fe2+;Fe2+在较强的氧化剂作用下会被氧化成Fe3+ 。在一定条件下,三者可以相互转化。
【板书】2.Fe和Fe3+和Fe2+的转化
【学生揭秘】揭秘时刻:
这节课开始的时候我们所做的魔术,“铁”字放入的第一杯液体是含Fe2+ 和SCN- 的混合溶液,再放入的第二杯液体是过氧化氢或其它氧化剂,过氧化氢等氧化性将溶液中的Fe2+氧化生成Fe3+,Fe3+遇SCN-显红色,所以显示出红色的“铁”。
【思考与讨论】Fe、FeSO4和Fe2(SO4)3三种物质中,哪种物质可做氧化剂,哪种可做还原剂,哪种既可做氧化剂又可做还原剂?举例写出相应反应的化学方程式,并加以说明。
【学生】Fe可以做还原剂,化合价可以升高,FeSO4既可以做还原剂又可以做氧化剂,Fe2(SO4)3可以做氧化剂,化合价可以降低。
①Fe+2H+=Fe2++H2↑
②Fe2++Mg==Fe+Mg2+
③2Fe2+ + Cl2 === 2Fe3+ +2Cl-
④2Fe3++Fe=3Fe2+
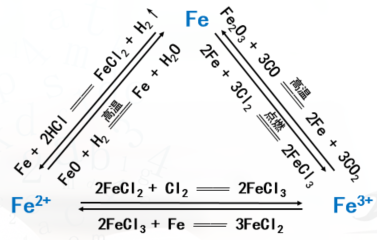
【思考与讨论】请你用图示的方法归纳Fe、Fe2+和Fe3+三者之间的相互转化关系,并与同学讨论。
【学生】

【过渡】下面利用所学知识来做一个拓展应用。利用覆铜板制作图案。
【学生分组探究】利用覆铜板制作图案
活动主题 |
利用覆铜板制作图案 |
活动背景 |
电子工业中常用覆铜板(以绝缘板为基材,一面或两面覆以铜箔,经热压而成的一种板状材料)为基础材料制作印刷电路板,印刷电路板广泛用于电视机、计算机、手机等电子产品中。用覆铜板制作印刷电路板的原理是,利用FeCl3溶液作为“腐蚀液”将覆铜板上不需要的铜腐蚀。即把预先设计好的电路在覆铜板上用蜡或不透水的物料覆盖,以保护不被腐蚀;然后,把覆铜板放到FeCl3溶液中。
|
活动目的 |
根据工业上制作印刷电路板的原理,利用覆铜板制作所需要的图案。 |
活动步骤 |
取一小块覆铜板,用油性笔在覆铜板上画上设计好的图案,然后浸入盛有FeCl3溶液的小烧杯中。过一段时间后,取出覆铜板并用水清洗干净。观察实验现象,并展示制作的图案。 |
活动成果 |
|
思考 与 讨论 |
(1)在上述实验中,发生了什么化学反应,生成的主要产物是什么?请运用氧化还原反应的规律进行分析,并尝试写出反应的化学方程式。 实验原理:2Fe3++Cu=2Fe2++Cu2+ (2)为使使用后的“腐蚀液”能得到充分利用,如何处理使用后的“腐蚀液”? (2)先加入适量的铁粉与废液中Cu2+反应,回收铜;再向废液中加人氯水等氧化剂,实现FeCl3溶液的再生。 |
【投影】本节小结。
【板书】 铁盐和亚铁盐
1.铁盐:Fe3+的盐
①Fe3+的检验:滴KSCN溶液,若溶液变红,证明有Fe3+
②Fe3+转化为Fe2+
2Fe3++Fe=3Fe2+
2. 亚铁盐:Fe2+的盐
Fe2+转化为Fe3+
2Fe2++Cl2=2Fe3++2Cl- 2Fe2++H2O2+2H+=2Fe3++2H2O
3.Fe和Fe3+和Fe2+的转化: 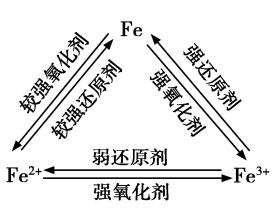
4. 拓展应用:利用覆铜板制作图案
实验原理:2Fe3++Cu=2Fe2++Cu2+
设为正确答案