- 时间点:
- 时 分 秒 当前视频时间点
- 问题:
-
- 选项一
设为正确答案
新增选项 - 选项一
- 正确跳转时间:
- 时 分 秒 同锚点时间
- 错误跳转时间:
- 时 分 秒 同锚点时间


恭喜你,回答正确~
很遗憾,回答错误~
正确答案: ,您可以



“铁的重要化合物”是必修一第三章“金属及其化合物”第二节“几种重要的金属化合物”的内容,在中学化学教学中占有重要地位,且金属及其化合物学习方法的归纳与总结,对后续章节的学习也有着重要的指导作用。学生已经在初中对铁单质的性质有所学习,生活中也经常接触铁及其化合物,对这些物质有一些了解,在学习钠和铝及其化合物时也介绍了金属、碱性氧化物、氢氧化物的概念。本节课将在此基础上,着重讲授“铁的氧化物”和“铁的氢氧化物”。
课件、实验(制备氢氧化亚铁和氢氧化铁的仪器和药品)、实验视频(提前录制)、实物(青砖、红砖)等
1.通过对铁的重要化合物的学习,了解铁的化合物在生活生产中的应用,感受化学学科的价值;
2.通过实验探究,掌握Fe(OH)2和Fe(OH)3的制备,建立铁元素转化的反应理论模型;
3.通过对Fe(OH)2制备方案的改进,提出新的实验实验设想,形成创新意识;
4.通过比较、归纳等,掌握学习元素化合物知识的一般方法。
教学重点:
铁及其重要化合物的主要性质和应用;
教学难点:
铁(II)与铁(III)的转化;
探究Fe(OH)2的制备方法;
讲授法、演示法、归纳比较法、模型构建、自主学习、实验探究、合作讨论
整体设计思路:
1.生活实例引入新课→
2.自主学习,快速掌握铁的氧化物的性质→
3.小组合作,完成实验,制备铁的氢氧化物→
4.通过宏观现象,微观分析Fe(OH)2转化为Fe(OH)3→
5.比较、归纳Fe(OH)2和Fe(OH)3的性质→
6.发散思维,创新探究,如何长时间观察到Fe(OH)2白色沉淀
板书设计:
大家来看一看,我现在手上拿的是什么呀?(红砖与青砖)这两块砖头是由同一种材料烧制而成,可它们呈现出的颜色却不一样,这是为什么呢?
【设计意图】
用生活中的实物引入,引发学生的学习兴趣。
【过渡】请同学们带着疑问,阅读教材59页,并完成学案的第一个表格。
【学生活动】自主学习,阅读教材,完成学案第一个表格。
【设计意图】
学生快速掌握铁的氧化物的知识。
【教师点评】
氧化亚铁 | 氧化铁 | 四氧化三铁 | |
化学式 | FeO | Fe2O3 | Fe3O4 |
俗称 | 铁红 | 磁性氧化铁 | |
Fe的化合价 | +2 | +3 | +2、+3 |
色、态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
与酸反应 (离子方程式) | FeO+2H+== Fe2++H2O | Fe2O3+6H+== 2Fe3++3H2O | Fe3O4+8H+== 2Fe3++Fe2++4H2O |
用途 | 红色油漆、 涂料 | 磁铁 |
【设计意图】用表格将知识直观化,更简单明了。
【教师讲解】
1.关于Fe3O4中Fe的化合价,我们在学习Fe与水蒸气的反应中,介绍过Fe3O4,它是一种复杂的化合物,可以写成什么形式呢?因此,Fe3O4中Fe的化合价应该是+2价和+3价。
2.关于Fe3O4的用途,请大家看看我手上拿的是什么呀?磁铁在我们物理实验室中经常看见,那么磁铁中磁性物质的主要成分是什么呢?对,就是Fe3O4。
【学生活动】
1.Fe3O4可以写成FeO·Fe2O3的形式;
2.磁铁中磁性物质的主要成分是Fe3O4;
【过渡】通过对铁氧化物的对比分析,大家能不能总结出FeO和Fe2O3共同的化学性质呢?
【教师讲解】我们把能与酸反应生成一种盐和水的化合物定义为碱性氧化物,所以,FeO和Fe2O3都是碱性氧化物。
【教师提问】那么,Fe3O4呢?它是不是碱性氧化物呢?
【学生回答】
1.FeO和Fe2O3都能与酸反应生成盐和水;
2.Fe3O4不是碱性氧化物,因为它与酸反应生成了两种盐;
【教师讲解】Fe3O4不是碱性氧化物,因为它与酸反应生成了两种盐,分别是铁盐和亚铁盐。
物质模型:碱性氧化物 (FeO、Fe2O3)
化学反应理论模型:碱性氧化物 + 酸 →盐(一种盐) + 水
【设计意图】
自主学习,结合对铁的氧化物的学习,独立思考;建立物质模型和化学反应理论,培养学生的学科素养。
【过渡】联系我们刚才所学的知识,现在,大家能不能解释为什么红砖呈红色,而青砖呈灰绿色呢?、
【学生回答】红砖含有Fe2O3,呈红色;青砖含有FeO,呈灰黑色。
【设计意图】
根据所学铁的氧化物的知识,理解红砖与青砖的颜色区别。
【过渡】我们在学习金属及其化合物的时候,一般是遵循从“单质→氧化物→氢氧化物→盐”,这样一种学习方法。以我们今天的学习对象Fe为例,我们首先介绍了它的氧化物。那么接下来我们将要学习它的氢氧化物。
【过渡】请同学们翻到教材60页,小组合作,完成实验3-9,并将实验现象和方程式填写在学案的第2个表格。
(1)Fe(OH)2和Fe(OH)3的制备
FeCl3+NaOH | FeSO4+NaOH | |
实验现象 | 红褐色沉淀 | 白色絮状沉淀迅速变成灰绿色,最后变成红褐色 |
化学方程式 | FeCl3+3NaOH=== Fe(OH)3+3NaCl | FeSO4+2NaOH=== Fe(OH)2+Na2SO4 |
离子方程式 | Fe3++3OH-=== Fe(OH)3 | Fe2++2OH-=== Fe(OH)2 |
【设计意图】
通过表格的形式,快速掌握实验现象和化学方程式。
【教师提问】B同学,在制备Fe(OH)3的过程中,你观察到了什么现象?
【学生回答】1.生成红褐色沉淀;
【过渡】我们经常说,化学反应就是宏观看现象,微观析本质,符号来表示。我们一起来看看C同学的方程式写对了吗?
【教师提问】D同学,你在制备Fe(OH)2的过程中,观察到了什么现象呢?
【学生回答】2.生成白色絮状沉淀,迅速变成灰绿色;
【教师提问】现在再观察一下制备Fe(OH)2的试管,与刚刚完成实验的试管进行对比,大家看看试管内壁上发生了什么变化呢?
【学生回答】3.试管内壁上的沉淀变成了红褐色;
【总结】所以,制备Fe(OH)2完整的实验现象应该是白色絮状沉淀迅速变成灰绿色,最后变成红褐色。我们再来看看E同学方程式的书写,写对了吗?
【设计意图】
根据宏观的实验现象,从微观的角度予以解释,培养学生的学科素养。
(2)Fe(OH)2转化为Fe(OH)3
4Fe(OH)2+O2+2H2O===4Fe(OH)3
【教师提问】对于铁的氢氧化物的制备过程,大家有没有什么疑问呢?
【学生回答】1.为什么白色絮状沉淀迅速变成灰绿色,最后变成红褐色?
【教师讲解】我们首先来看看这个白色絮状沉淀是什么?红褐色沉淀呢?这说明Fe(OH)2转化为了Fe(OH)3。
【学生回答】2.白色絮状沉淀是Fe(OH)2,红褐色沉淀是Fe(OH)3;
【教师提问】这个转化是如何实现的呢?请大家观察这个反应,它属于哪种反应类型?
【学生回答】3.该反应属于氧化还原反应;
【教师讲解】现在,我们一起来分析一下它的化合价的变化。Fe:从+2价升高到了+3价;O:从0价降低到了-2价,因此在这个过程中,Fe(OH)2被氧化,O2作氧化剂。将这个过程建立化学反应理论模型,+2铁要升高至+3价,那么应该向反应体系中添加什么呢?
化学反应理论模型:
【过渡】这个反应理论模型也可以运用到红砖与青砖的制作工艺中。请大家阅读材料,思考,红砖与青砖制作工艺的区别在哪里?并且产生了什么结果?
【学生回答】4.红砖是自然冷却,青砖是通过淋水让其冷却;
【教材辅读】
红砖与青砖都是用粘土(富含铁元素)高温烧制而成。
红砖(Fe2O3):用大火将砖坯从外到里烧透,然后停下,将砖和窑体慢慢冷却(窑内空气流通)。
青砖(FeO):在砖坯烧透之后,从窑顶不断向下淋水(水在高温的环境下,迅速变成水蒸气,且能产生CO和H2)使砖冷却。
【设计意图】
建立物质模型和化学反应理论模型,培养学生的学科素养。
(3)Fe(OH)2和为Fe(OH)3的比较
【过渡】刚才我们已经通过实验制得了铁的氢氧化物,发现它们都是不溶性碱,那么大家能不能写出它们与酸反应的化学方程呢?请大家自主学习,完成学案的第3个表格。
Fe(OH)2 | Fe(OH)3 | |
Fe的化合价 | +2 | +3 |
色、态 | 白色固体 | 红褐色固体 |
溶解性 | 难溶于水 | 难溶于水 |
与盐酸反应 (化学方程式) | Fe(OH)2+2HCl=== FeCl2+2H2O | Fe(OH)3+3HCl=== FeCl3+3H2O |
热稳定性 | Fe(OH)3=△=Fe2O3+H2O |
【设计意图】
用表格将知识直观化,更简单明了。
【过渡】 这节课我们主要学习了铁的氧化物和氢氧化物,对于铁的氧化物,主要强调了它的应用;对于氢氧化物,主要介绍了它的制备、转化以及它们之间的比较。在制备Fe(OH)2的过程中,可以发现白色沉淀的存在时间是非常短暂的,那么我们应该如何改进实验方案,才能长时间地观察到白色沉淀呢?大家小组之间进行讨论与交流,提出解决方案。
【小组交流与讨论】
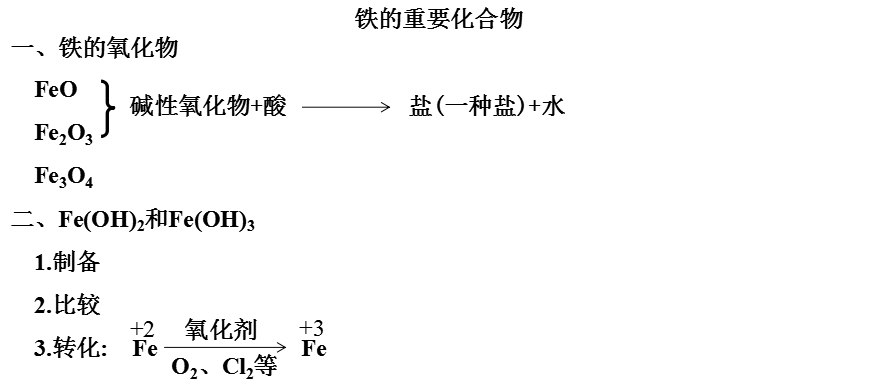
【学生方案一】
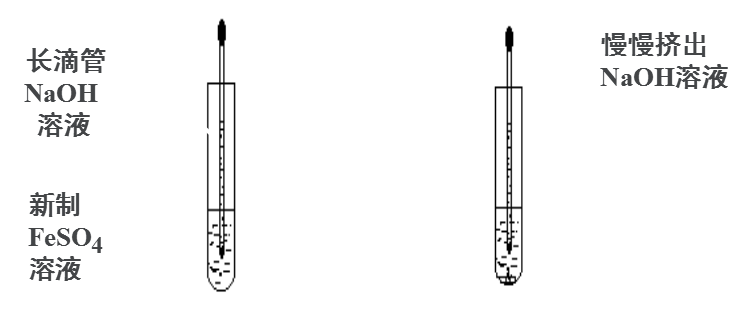
【学生方案二】
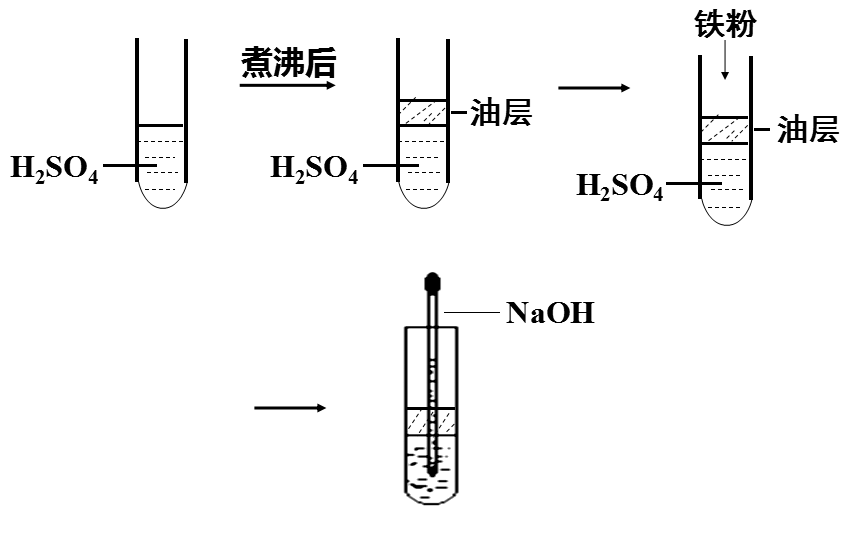
【结论】
1.油封(在液面上覆盖一层苯或煤油);
2.通入其他气体;
3.将配置溶液的蒸馏水煮沸;
【设计意图】
通过小组讨论,探究如何改进实验方案,给学生以主动探索和解决问题的空间。
【观看视频】
观看由教师提前录制的制备氢氧化亚铁的实验视频,验证学生讨论结果。
1.指南针是我国古代四大发明之一,制造指南针的磁性物质的主要成分是 ( )
A.FeO B.Fe2O3 C.Fe3O4 D.Fe
2.某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色。下列关于原溶液的说法正确的是 ( )
A.一定含有Fe2+,一定不含有Fe3+、Mg2+
B.一定含有Fe3+,一定不含有Fe2+、Mg2+
C.一定含有Fe3+,可能含有Fe2+,一定不含有Mg2+
D.一定含有Fe2+,可能含有Mg2+,一定不含有Fe3+
3.下列关于Fe(OH)2的制备能够成功的是 ( )
A.向FeCl2溶液中逐滴加入NaOH溶液
B.向FeSO4溶液中逐滴加入氨水
C.先将装有NaOH溶液的长滴管插入FeSO4溶液液面下,再挤出NaOH溶液可制得Fe(OH)2白色沉淀
D.取适量新配置的FeSO4溶液于试管中,然后向试管内逐滴加入NaOH溶液
设为正确答案