- 时间点:
- 时 分 秒 当前视频时间点
- 问题:
-
- 选项一
设为正确答案
新增选项 - 选项一
- 正确跳转时间:
- 时 分 秒 同锚点时间
- 错误跳转时间:
- 时 分 秒 同锚点时间


恭喜你,回答正确~
很遗憾,回答错误~
正确答案: ,您可以



1.《铁及其化合物》位于新教材的第三章第一节,教材在介绍铁的化合物时,分为铁的氧化物、铁的氢氧化物、铁盐和亚铁盐三部分内容。铁作为变价金属元素的典型代表,在元素化合物的学习中有重要地位。
2.铁的氢氧化物是铁的重要化合物之一,作为铁的化合物的典型类别有重要地位;教材从制备方法直接介绍铁的氢氧化物,编排了实验3-1和图3-8来对比氢氧化铁和氢氧化亚铁制备的相似处和现象不同点,然后提出问题为什么白色絮状沉淀会迅速变灰绿色,最终变红褐色?并指出是氧气的问题,然后介绍铁的氢氧化物的不稳定性和不溶性,最后提出思考题:实验室里,如何得到氢氧化亚铁?
3.新旧教材比较,主体知识系统保留。
新增:思考与讨论,实验室里,如何得到氢氧化亚铁?更加重视实验探究能力的培养。
调整:旧教材中图3-18 氢氧化亚铁的颜色无法看到白色,而新教材中图3-8能清楚地看到白色的氢氧化亚铁,避免了误导的可能。
将旧教材的【学与问】铁的氢氧化物与酸反应变为正文内容。
1.初中阶段比较肤浅地了解铁的一些基础知识,对其氢氧化物还比较陌生。
2.在第一章学习了离子反应、氧化还原反应等知识,在教学过程中要考虑新旧衔接,加深对具体反应的理解,又可以巩固旧知。
3.第二章学习了典型的金属元素钠,需要从价态的角度与之区别,并从本质上了解铁是一种变价金属。
4.在金属钠与水的学习中,了解了典型探究实验的步骤与思维模式,可应用于本内容的学习,继续进一步提高学生的探究能力。
5.钠或氧化钠都可以一步转化成氢氧化钠,可以与铁及其化合物的转化做对比,引出铁的氢氧化物的制备。
1. 掌握从物质类别、物质所含核心元素的化合价这两个基本角度去预测和解释铁及其化合物间的转化的学科思维方法.
2.分析氢氧化亚铁易被氧化的原因,提升学生宏观辨识与微观探析素养。
3.掌握氢氧化铁、氢氧化亚铁的制备方法,探究制备氢氧化亚铁实验的改进方案,培养学生的科学探究与创新意识。
4.通过对氢氧化铁、氢氧化亚铁的制备方法的探究,让学生体验科学探究的过程。
重点:氢氧化铁与氢氧化亚铁的制备与性质;
难点:通过实验探究成功制备氢氧化亚铁。
3.1.3 铁的氢氧化物
一、制备 可溶性盐+碱 问题:看不见白色
1. Fe(OH)3 Fe3+ + 3OH- ══ Fe(OH)3↓(红褐色) 关键:排除O2或空气
2. Fe(OH)2 Fe2+ + 2OH- ══ Fe(OH)2↓(白色) 方法:1.加Fe
二、性质 2.煮沸
4Fe(OH) 2+ 2H2O + O2 ══ 4Fe(OH)3 3.覆盖油
Δ 4.胶头滴管伸入液面以下
2Fe(OH)3 ══ Fe2O3 + 3H2O 5.用氢气排O2或空气
铁及其化合物是大家的老朋友,我们先来玩个超级分类的游戏。
1.请根据物质类别对铁及其化合物进行分类
2.请根据铁元素的价态对铁及其化合物进行分类
游戏中有两个视角:物质类别和元素价态,我们一直是这样认识元素化合物的。
1.铁元素常见的化合价有哪些?与金属钠比较起来有什么不同。
钠在化合物中只有一种价态,一般金属都是如此,而铁在化合物中有多种价态,是典型的变价金属。
2.物质类别上与钠相似,主要关注铁的单质、氧化物、氢氧化物和盐,今天的主角是铁的氢氧化物。
(1)铁的氢氧化物有哪些?与钠的氢氧化物比较。
(2)氢氧化钠可以由钠与水或者氧化钠与水反应一步得到,氢氧化铁可以由其单质和氧化物一步反应得到吗?不可以
那么,从类别上看,就只剩下一个方向了,由盐转化得到。可以吗?
3. 我们来看看实验视频——氢氧化铁和氢氧化亚铁的制备。
视频告诉我们是可以的,原理:可溶性盐+碱 反应。
一、铁的氢氧化物的制备
1.Fe(OH)3的制备
实验3-1-1 (学生代表实验、教师同屏投影)
步骤:向试管中加入少量的氯化铁溶液,然后滴入氢氧化钠溶液 。
实验现象:有红褐色沉淀产生。
离子方程式:Fe3++3OH-=Fe(OH)3↓
2.Fe(OH)2的制备
从物质类别的角度看,氢氧化亚铁也属于铁的氢氧化物,可由亚铁盐和氢氧化钠制备得到。
Fe2+ + 3OH- ══ Fe(OH)2↓
实验3-1-2 (4人一组进行分组实验,教师指导、纠错,希沃助手抓拍典型实验现象)
步骤:向试管中加入少量的硫酸亚铁溶液,然后滴入氢氧化钠溶液。
学生实验结束后,教师用希沃助手展示随机抓拍的4张照片
问题:照片中沉淀的颜色?
氢氧化亚铁是什么颜色的?
[阅读]阅读与思考:阅读教材67页最后一个自然段,思考到底哪支试管中的氢氧化亚铁才是真相?为什么?

![]()
氢氧化亚铁是白色的
[问题]异常现象产生的原因是什么?
因为氧气氧化了二价的亚铁
实验现象:产生白色沉淀、迅速变灰绿,过一段时间还会有红褐色物质生成。(可能看不到白色)
化学反应方程式:![]()
4Fe(OH) 2+ 2H2O + O2 ══ 4Fe(OH)3
判断氧化还原反应中的氧化剂和还原剂,并用单线桥表示电子的转移。
二、氢氧化亚铁制备的探究实验
实验3-1-2中看不见白色的氢氧化亚铁,下面我们就来探究解决这个问题。
探究主题:改进实验3-1-2制得白色的Fe(OH)2
[思考与讨论] 4人一组分组讨论,给学生充分的讨论时间,然后进行师生交流。学生先分享,教师做必要的引导和补充。
1.实验3-1-2中,很难观察到Fe(OH)2的颜色——白色,原因是什么?
解决它的关键点是什么?
原因:二价铁极易被氧气氧化 关键点:排除装置中的氧气或空气
2.实验3-1-2中,氧气会存在在哪里?
氧气溶解在FeSO4溶液和NaOH溶液中;
胶头滴管滴加过程中,溶液与空气接触;
存在于试管中,空气与液面接触。
3.请从试剂处理和操作手段方面思考如何防止Fe(OH)2被氧气氧化?
用煮沸过的蒸馏水配制FeSO4溶液和NaOH溶液,现配现用;
在FeSO4溶液中放入少量单质铁;
滴加NaOH溶液的胶头滴管的尖端插入FeSO4溶液液面以下;
在试管中FeSO4溶液液面上加一层植物油、煤油等;
用H2将装置内的空气排尽。
[分组实验探究] 4人一组
预测:除装置中的氧气或空气后,可制得Fe(OH)2白色沉淀。
实验:利用所提供的实验仪器、药品改进实验3-1-2。
观察、描述
分析得出结论
分享:分享成功的秘诀或分析失败的原因。
反常规法
中学化学唯一把胶头滴管插入反应溶液的实验!
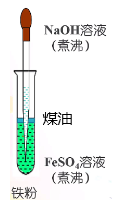

教师用微视频分享改进实验。
1.用下面两种方法可以制得白色的Fe(OH)2沉淀:
方法一、用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)除去蒸馏水中溶解的O2常采用________的方法。
(2)生成白色Fe(OH)2沉淀的操作可采用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.
这样操作的理由是 。
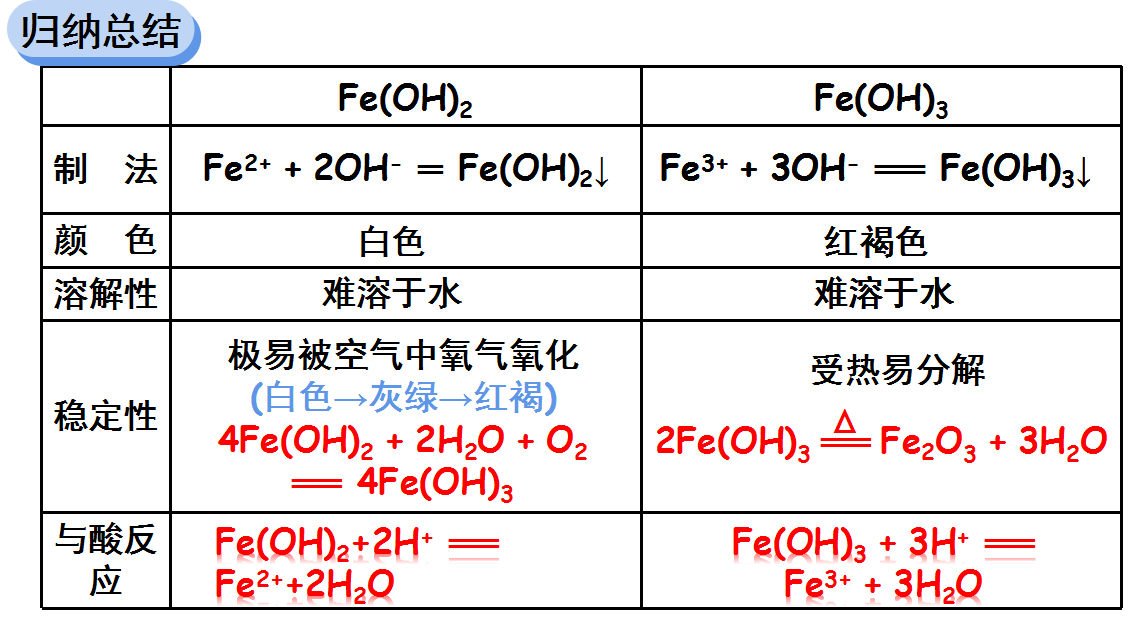
三、氢氧化铁与氢氧化亚铁的性质比较
比较氢氧化亚铁和氢氧化铁的制法、颜色、溶解性、稳定性、与酸反应情况
[游戏反馈]
希沃课堂活动——游戏竞争
主题:有关氢氧化亚铁,形式:2人pk
课时作业131页第6、7、8和10题
设为正确答案