- 时间点:
- 时 分 秒 当前视频时间点
- 问题:
-
- 选项一
设为正确答案
新增选项 - 选项一
- 正确跳转时间:
- 时 分 秒 同锚点时间
- 错误跳转时间:
- 时 分 秒 同锚点时间


恭喜你,回答正确~
很遗憾,回答错误~
正确答案: ,您可以



学生在初中已经学习过碳酸钠和碳酸氢钠的部分知识,可以此展开,继续深入学习碳酸钠和碳酸氢钠的性质,并完成钠及化合物知识体系构建。在研究时,主要围绕着碳酸钠和碳酸氢钠的已知用途展开,然后通过实验对两者的物理性质、化学性质进行逐步的探究,最终再回到用途。整个过程紧紧围绕着“性质决定用途,用途反映性质”这一主线。
本节共安排了2个实验、1个视频实验,将碳酸钠和碳酸氢钠的学习融合在其中,给学生以大量的感性认识,引导学生通过对实验现象的分析,找出规律性的知识,并依据这些规律性知识,进一步对碳酸钠和碳酸氢钠的性质作出推断和预测。在整个学习过程中,观察法、对比法、类比法、归纳法等各种科学方法交织运用。这种设计的目的是让学生亲历类比预测----实验----解释----得出结论的过程。通过该过程,让学生进一步构建金属及其化合物的研究模型,为学生后续学习铁及其化合物等奠定了基础。

(1)了解碳酸钠和碳酸氢钠的主要性质,正确书写有关的化学方程式。
(2)以碳酸钠和碳酸氢钠知识的学习为线索,初步形成物质转化可通过条件控制实现的化学观念。
(3)在研究碳酸钠和碳酸氢钠性质的过程中,能依据研究目的设计探究方案,形成证据推理意识,培养求实、创新的良好品质。
(4)培养学生描述宏观的实验现象,用微观的化学符号和化学术语来解释这些实验现象。
(5)通过学习碳酸钠和碳酸氢钠、在生产和生活中的应用,感受化学的魅力,发展社会参与意识。
(6)了解与纯碱有关的化学史,感受化学工业发展中技术进步的重要性,体会建设生态文明的意义。
重点:碳酸钠和碳酸氢钠的性质比较;钠及其化合物的研究思路和方法的建构。
难点:碳酸钠和碳酸氢钠的相互转化与鉴别方法。
碳酸钠和碳酸氢钠
Na2CO3 NaHCO3
一、用途
二、物理性质 颜色状态 白色粉末 细小的白色晶体
溶解性 Na2CO3> NaHCO3
三、化学性质
1、碱性 Na2CO3> NaHCO3
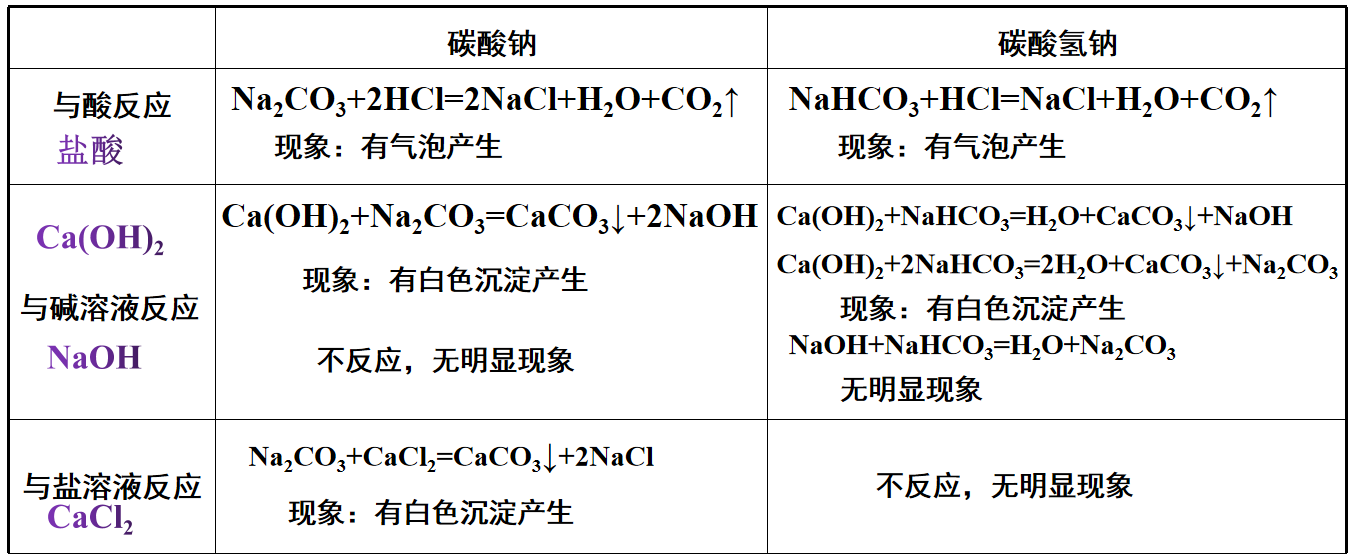
2、和盐酸反应 Na2CO3 +HCl= NaHCO3+NaCl NaHCO3+HCl= NaCl+CO2↑+H2O
NaHCO3+HCl= NaCl+CO2↑ +H2O
现象:有气泡产生 现象:有气泡产生
3、和Ca(OH)2溶液反应 Na2CO3+Ca(OH)2= CaCO3↓+2NaOH NaHCO3+Ca(OH)2= CaCO3↓+H2O+NaCl
2NaHCO3+Ca(OH)2= CaCO3↓+2H2O+ Na2CO3
现象:有白色沉淀产生 现象:有白色沉淀产生
4、和BaCl2溶液反应 Na2CO3+BaCl2=BaCO3↓+2NaCl 不反应
现象:有白色沉淀产生 现象:有白色沉淀产生
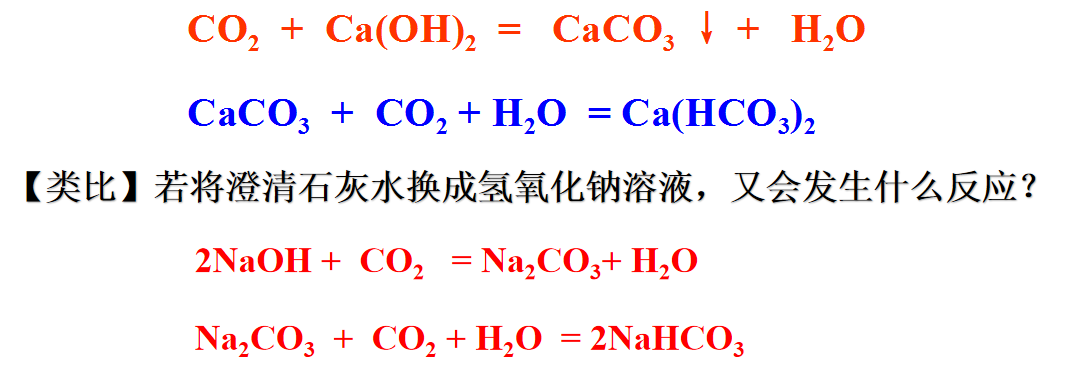
在初中我们就已经知道了碳酸钠和碳酸氢钠。你还记得它们的俗称和用途吗?

【实验2-4】在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填.入下表。
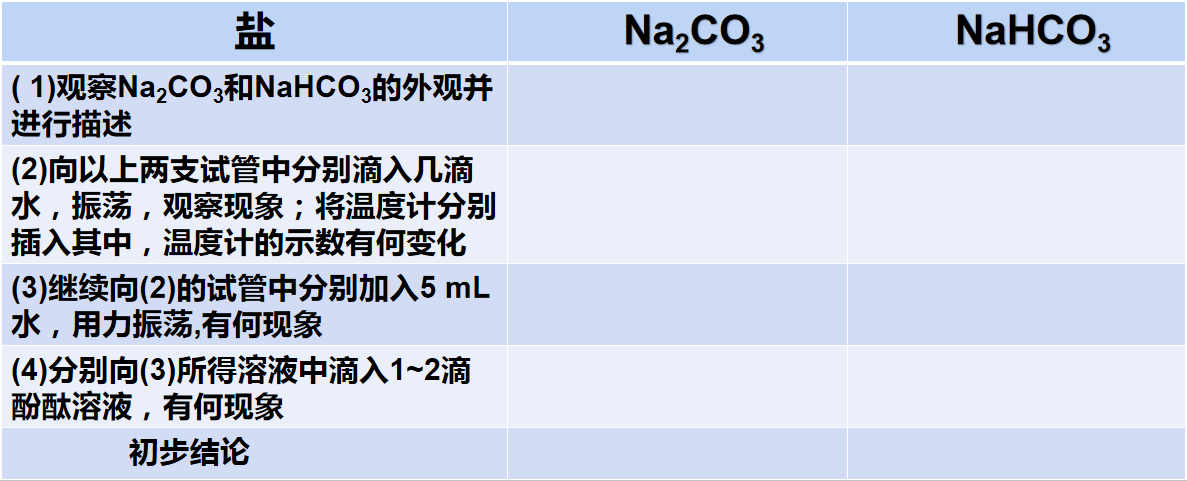

思考问题 胃酸的主要成分是盐酸,医学上常用NaHCO3来胃酸过多,为什么不用Na2CO3?
因为Na2CO3的碱性比NaHCO3强
碳酸钠溶液呈碱性,能和油脂发生反应,可以用于去油污。
提出问题 碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一,我们发现,加入发酵粉的面团加热焙烤后变得蓬松,体积比原来大了好多。你知道原因是什么吗?
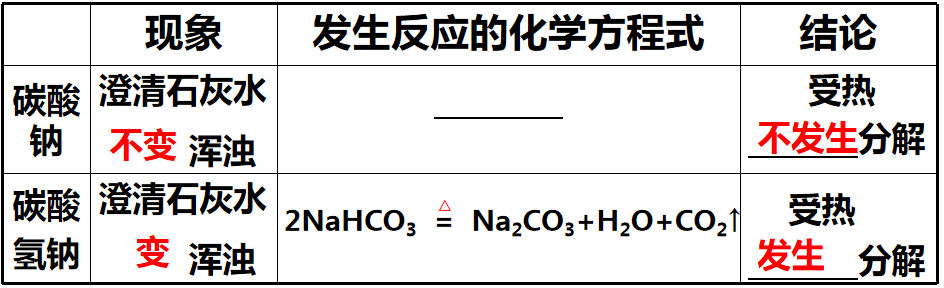
【思考】碳酸钙受热会分解,碳酸钠和碳酸氢钠呢?
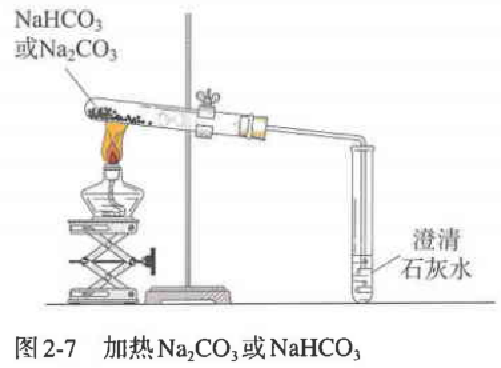
【实验2-5】如图2-7所示,分别加热Na2CO3和NaHCO3,观察现象,比较Na2CO3和NaHCO3的热稳定性。
【知识拓展】
验过程中,若通入二氧化碳时间较长,发现澄清的石灰水先变浑浊然后又变清,你知道为什么吗?
解决问题
碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一,我们发现,加入发酵粉的面团加热焙烤后变得蓬松,体积比原来大了好多。你知道原因是什么吗?

根据前面所学习的物质转化,哪类物质能和碳酸钠、碳酸氢钠反应
碳酸钠、碳酸氢钠都是盐,盐可以和某些酸碱盐发生复分解反应,反应发生的条件:产生沉淀、气体、水、弱酸、弱碱。:
1、盐和酸=新盐+新酸
2、盐和碱=新盐+新碱
3、盐1和盐2=新盐1+新盐2
【化学观念构建】
通过碳酸钠和碳酸氢钠的对比学习,我们发现反应物用量配比不同,产物也会不同。
通过钠的学习,我们发现钠和氧气反应条件不同,产物也会不同
由此可见 ,我们可根据生产生活的需要,对反应条件和反应物的用量配比进行控制。
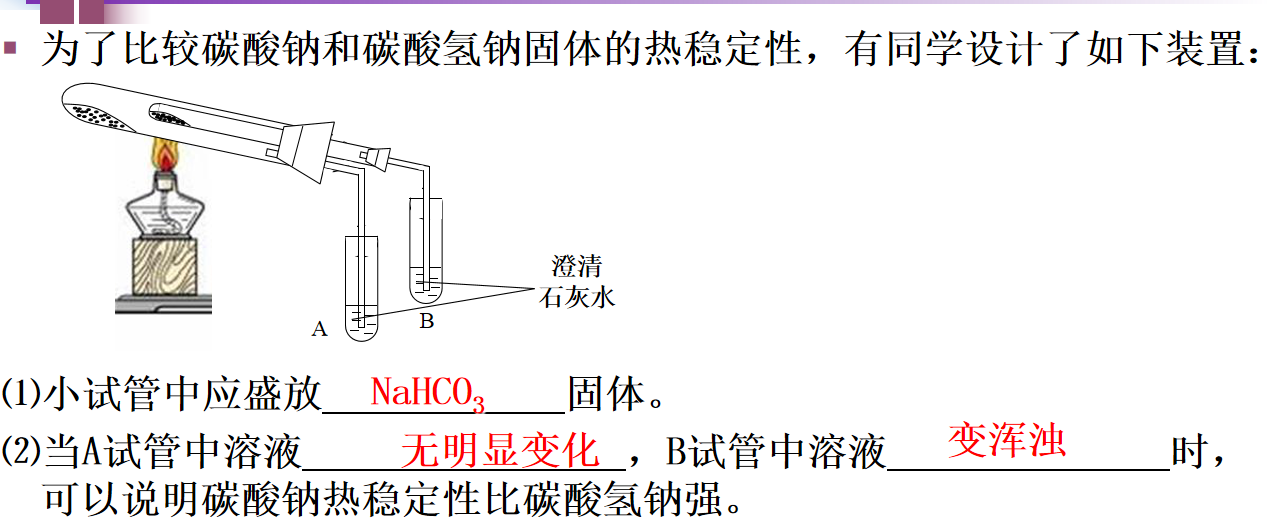
从理论上分析了碳酸钠和碳酸氢钠与盐酸的反应原理及现象后,设计了如下实验经行验证。
在两支试管中分别加入5ml同浓度的Na2CO3溶液和NaHCO3溶液,分别向试管逐滴加入相同浓度稀盐酸,观察并记录实验现象

【思考】患有胃溃疡的病人能否使用碳酸氢钠来治疗胃酸过多
不能,会加重胃溃疡,甚至导致胃穿孔
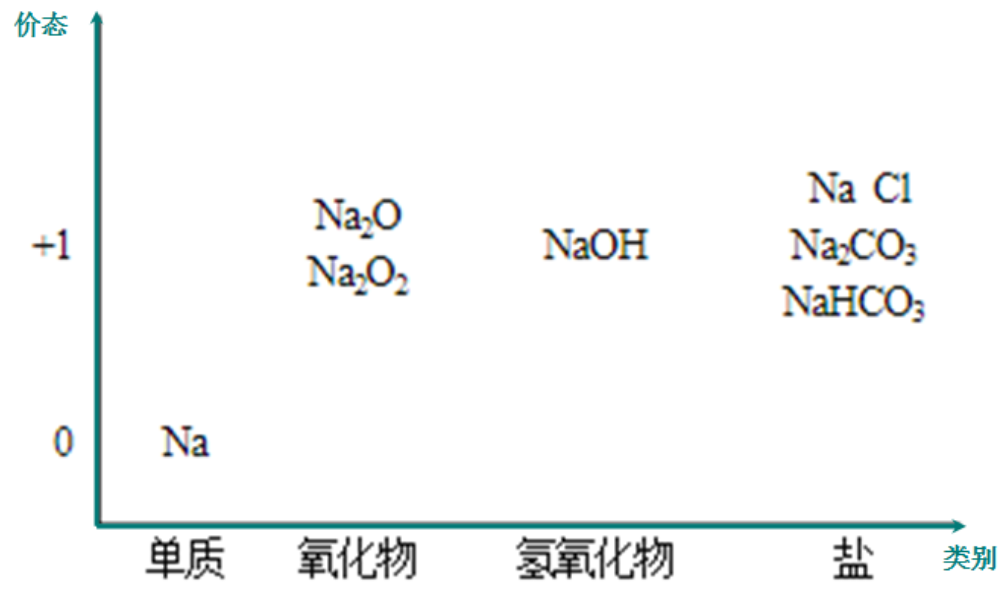
从元素合价和物质类别两个角度研究物质的性质,是一种行之有效的方法。元素的价-类二维图是我们学习元素及其化合物相关知识的重要模型和工具。画出它们之间的转化关系,并写出相关的化学方程式或离子方程式。(课后完成)
1890年,侯德榜出生于福建省闽侯县。1921年在美国获博士学位。怀着振兴祖国民族工业的决心,1921 年侯德榜接受爱国实业家范旭东的邀请,毅然回国到永利碱业公司负责技术开发工作。在侯德榜的努力下,永利碱厂生产出了“红三角”牌纯碱,并在1926年美国费城万国博览会上荣获金奖,永利碱厂也成为当时亚洲第一大碱厂。抗日战争爆发后,侯德榜率西迁的员工建设永利川西化工厂。川西地区盐卤浓度较低,为了降低制碱成本,侯德榜开始对原有的制碱方法----氨碱法(以食盐、氨、二氧化碳为原料制取碳酸钠,又称索尔维法)进行改进。经过数百次的试验,侯德榜终于确定了新的工艺流程,将氨碱法制取碳酸钠和合成氨联合起来,这就是联合制碱法,也称侯氏制碱法。侯氏制碱法提高了食盐的转化率,缩短了生产流程,减少了对环境的污染,将制碱技术发展到一个新的水平,贏得了国际化工界的高度评价。侯德榜热爱祖国、自强不息和艰苦创业的精神,始终是后人学习的典范!
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl 
![]()
【评价任务一】

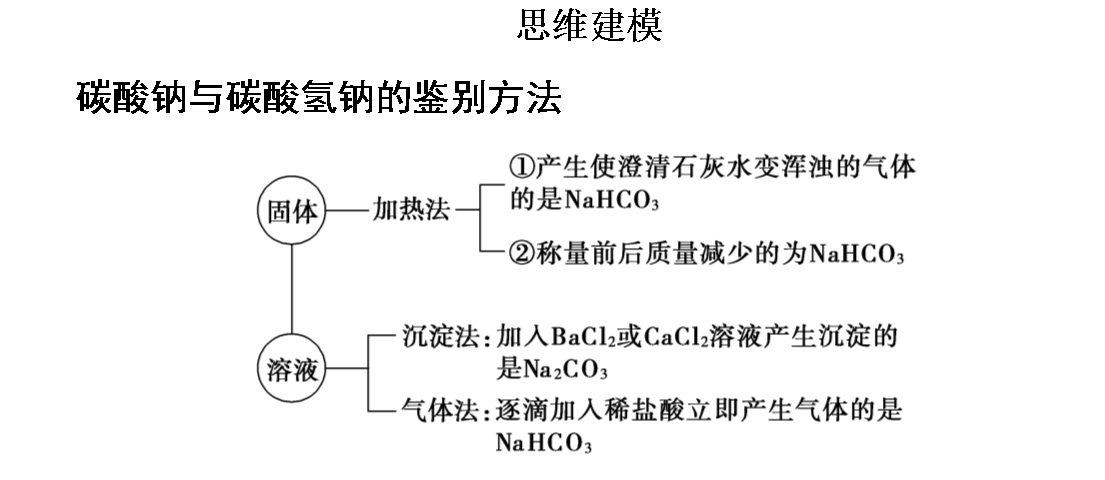
【评价任务二】
根据上述小结,请用在下列图示的箭头上下方填上合适的试剂,以实现两者的转化。并写出相关的化学反应方程式。
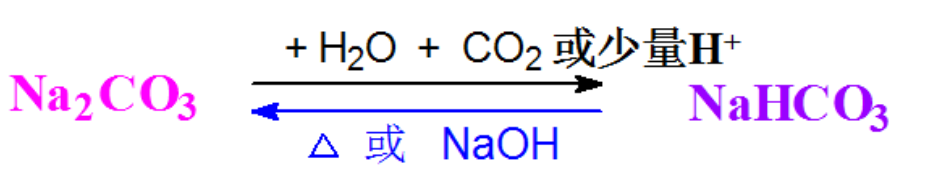
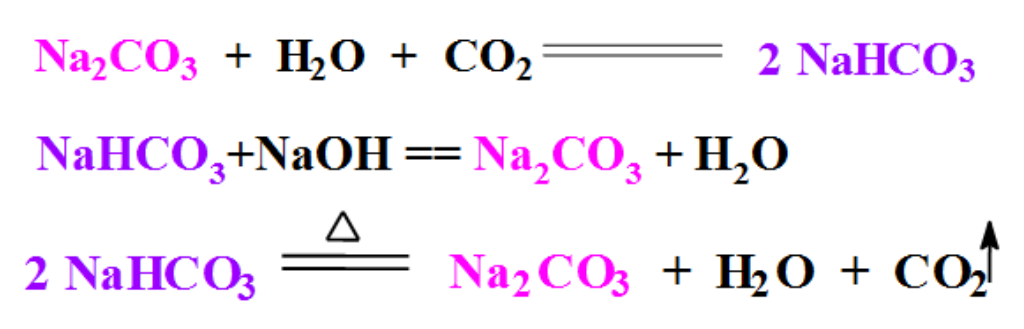
【评价任务三】
1)如何除去Na2CO3粉末中少量的NaHCO3?【答案】加热
(2)如何除去Na2CO3溶液中少量的NaHCO3?【答案】加适量的NaOH
3)如何除去NaHCO3 溶液中少量的Na2CO3 ?【答案】通入足量CO2
设为正确答案