- 时间点:
- 时 分 秒 当前视频时间点
- 问题:
-
- 选项一
设为正确答案
新增选项 - 选项一
- 正确跳转时间:
- 时 分 秒 同锚点时间
- 错误跳转时间:
- 时 分 秒 同锚点时间


恭喜你,回答正确~
很遗憾,回答错误~
正确答案: ,您可以



本课时是教材第三章第一节第二课时的内容,是教材中对于铁及其化合物知识的进一步延申。教材主要介绍了亚铁盐和铁盐,其重点是亚铁离子和铁离子的转化及两者的检验方法。为了更好激发学生的学习兴趣,加深学生对铁的化合物的理解,让学生体会铁元素在人体中的重要作用,本节选择学生比较熟悉的补铁物质入手,以检验铁试剂中的铁离子化合价为线索,逐步研究亚铁盐、铁盐以及相应离子的检验,让学生在学习化学知识的同时,体会化学在生活中的作用。学生在上一课时中已经熟悉了单质铁、铁的氧化物、铁的氢氧化物的性质,本节课在此基础上,学生要进一步学习铁盐的性质,理解可变价态元素的化学性质模型,为后面元素周期律的学习打下坚实的基础。
这个班学生整体基础相对比较好,通过第二章对钠及其化合物、氯及其化合物的学习。基本上能构建认识和学习元素化合物的一般学习方法。同时学生能够掌握一些基本的实验的操作的方法,所以本堂课大胆设计实验,并且设计简学案,提前让学生预习本节内容并完成学案。根据学生设计的实验方案,让学生独立完成实验,通过小组合作,让学生通过亲身的操作,真实的感受化学这门实验是以实验为基础的自然学科。
(1)通过学习铁盐和亚铁盐,学会从物质类别和元素价态的视角认识具有变价元素物质间的转化关系,并建立认识模型,丰富研究物质的思路和方法。
(2)通过实验探究铁盐和亚铁盐的化学性质,并能用化学方程式或离子方程式正确表示。体会实验对认识和研究物质性质的重要作用,形成证据意识。
(3)结合应用实例,将铁盐和亚铁盐的性质知识运用于解决生产、生活中简单的化学问题,强化性质决定用途的观念。
重点:铁盐和亚铁盐的转化,Fe3+的检验。
难点:Fe2+和Fe3+转化关系模型的构建。
第2课时 铁盐和亚铁盐
一、铁离子的检验
检验试剂:硫氰化钾(KSCN)
现象:溶液呈血红色
原理:Fe3++3SCN-=Fe(SCN)3
二、亚铁离子和铁离子的转化
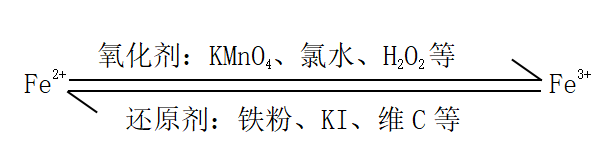
2Fe3++Fe=3Fe2+
教学环节 |
教师活动 |
学生活动 | 设计意图 |
| 导入 | 插入图片——某病人的血液检验单体。思考该如何补铁呢?生活中有哪些食物可以补铁? |
观察图片,分析得出病人出现贫血情况,与铁元素有关系。 |
引出主题,学生从生活实际出发,联想到常见的一些补铁的食物,例如菠菜等。 |
探究一:菠菜补铁是真的吗? |
民间传说:民间对于菠菜补铁的问题褒贬不一:一些人认为菠菜是作为日常补铁的最佳蔬菜。另一些人认为菠菜不能补铁。 结合之前的学习,引导学生依次思考分析得出Fe2+、Fe3+的检验方法。 增加专门用于检验Fe3+的一种方法,及KSCN(硫氰化钾)试剂,同时设计对照演示实验。演示分别向FeSO4和FeCl3溶液中滴加KSCN(硫氰化钾)溶液。学生观察实验现象。 |
学生根据自己已经掌握的知识,提出Fe2+、Fe3+的检验方法。 观察实验现象,得出结论。 |
培养学生的证据推理和模型认知的核心素养,也强化了科学的探究素养。 |
任务一:检验菠菜中是否存在 Fe2+、Fe3+? |
对菠菜进行一系列处理之后,得到菠菜汁液。 学生了解了Fe2+、Fe3+的检验方法后,引导学生对菠菜汁液进行检验。用KSCN(硫氰化钾)溶液演示实验。 老师演示:向菠菜汁液中滴加 KSCN溶液,观察溶液是否变微红,来验证是否存在Fe3+。 给出资料卡片,发现实际(菠菜汁液中含有Fe3+)和理论(资料显示菠菜汁液中含有Fe2+)不相符合,引导学生思考,问题所在? |
学生观察,引发思考第一,为什么是微红色而不是血红色? 第二,为什么实验结果和理论相冲突,这其中必定发生了Fe2+转化为Fe3+的反应。结合实验操作过程和氧化还原反应的原理,分析Fe2+被氧气氧化为Fe3+了。 |
培养学生观察能力和创新能力,让学生了解科学探究的基本方法,培养初步的科学探究能力 |
探究二:Fe2+与Fe3+间的相互转化 |
方法指导:结合氧化还原反应的原理,大家分析并归纳。 Fe2+→Fe3+ Fe2+→Fe3+ |
学生思考分析Fe2+和Fe3+的价态,得出两者的性质。并归纳:结合氧化还原反应的原理,如何实现Fe2+与Fe3+间的相互转化 | 让学生学会从物质类别和元素价态的视角认识具有变价元素物质间的转化关系,并建立认识模型,丰富研究物质的思路和方法 |
任务二:设计实验方案验证 Fe2+与Fe3+间的相互转化 |
请同学们分小组讨论:FeCl2和FeCl3的化学性质,设计实验方案验证,说明预测依据和设计理由。并按实验方案完成实验,得出结论。 |
学生完成学案。并动手操作实验,记录实验现象。 学生分小组谈论设计方案来鉴别,并完成学案。结合所给药品,完成实验操作并记录现象。 |
让学生学会利用氧化还原反应的角度分析,构建知识体系,培养理性思考能力。 |
归纳 |
|||
第一节 铁及其化合物
第2课时 铁盐和亚铁盐
班级 姓名 第 组 组长
一、教学目标
1、通过学习铁盐和亚铁盐,学会从物质类别和元素价态的视角认识具有变价元素物质间的转化关系,并建立认识模型,丰富研究物质的思路和方法。
2、通过实验探究铁盐和亚铁盐的化学性质,并能用化学方程式或离子方程式正确表示。体会实验对认识和研究物质性质的重要作用,形成证据意识。
3、结合应用实例,将铁盐和亚铁盐的性质的知识运用于解决生产、生活中简单的化学问题,强化性质决定用途的观念。
二、重难点:
1、重点:Fe2+、 Fe3+ 的检验以及Fe2+、 Fe3+ 的转化。
2、难点:Fe2+、 Fe3+ 的转化。
三、学生活动
探究二:Fe2+与Fe3+间的相互转化
方法指导:结合氧化还原反应的原理,大家分析并归纳。
任务二:设计实验方案验证Fe2+与Fe3+间的相互转化
(1)任务安排:请同学们分小组讨论,FeSO4溶液和FeCl3溶液的化学性质,设计实验方案验证,说明预测依据和设计理由。
(2)实验用品FeSO4溶液,FeCl3溶液,KMnO4溶液,KSCN溶液,铁粉。
(3)方案依据:
预测性质(预测依据) |
选取试剂(选取理由) |
预期现象(预期依据) |
Fe2+具有 性
Fe3+具有 性 |
滴加KMnO4溶液,现象
加入铁粉,现象 |
(4)实验过程:
实验内容 |
实验步骤 |
实验现象 |
结论 |
验证Fe2+转化为Fe3+ |
|||
结论:
|
|||
验证Fe3+转化为Fe2+ |
|||
结论:
|
|||
(5)归纳:
(6)评价与感悟:
设为正确答案